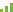 风湿消息
风湿消息
漫话风湿系列连载(九) 由表象到真相——ANCA的发现与系统性血管炎
(一)ANCA是什么,是谁发现的?
自身抗体,是指针对自身正常组织、器官、细胞及细胞成分的抗体。人体存在完整免疫系统,就像守卫城堡的士兵,通常情况下该系统产生的免疫反应有保护性防御作用。在某些疾病状态下,人体的免疫系统不再“认识”自己,反而产生大量针对自身的抗体,就可能对身体造成不同程度的损伤。抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibodies,ANCA)就是这样的一种自身抗体,所针对的抗原为自身体内的中性粒细胞和单核细胞胞浆成分。如果在血液中检测到这种抗体存在,就高度提示患者可能患有系统性小血管炎。
1982年Davies首先提出ANCA的存在,到了1985年,van der Woude等发现在重症肉芽肿性多血管炎(granulomatosis
with polyangiitis,GPA,原来称为韦格纳肉芽肿病)的血清中存在ANCA。1987年Savage发现在显微镜下多血管炎(microscopic polyangiitis,MPA)患者的血清中也存在ANCA。1988年Falk和Jennette又在某些坏死性新月体肾炎患者血清中能检测到ANCA。随后,在嗜酸粒细胞肉芽肿性多血管炎(eosinophilic granulomatosis with polyangiitis,EGPA,原来称为变应性肉芽肿性血管炎或Churg-Strauss 综合征)患者的血清中也发现了ANCA。目前显微镜下多血管炎、肉芽肿性多血管炎及嗜酸粒细胞肉芽肿性多血管炎统称为ANCA相关小血管炎。蛋白酶3(proteinase 3,PR3)和髓过氧化物酶(myeloperoxidase,MPO)是ANCA相关小血管炎(ANCA-associated vasculitis, AAV)中ANCA的两种主要特异性抗原。PR3-ANCA主要存在于GPA中,而MPO-ANCA主要存在于MPA和EGPA中。
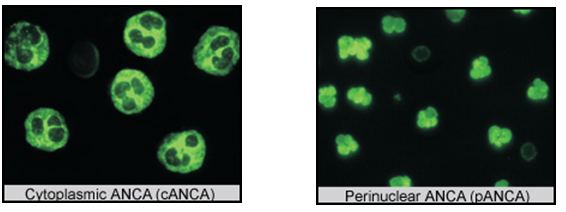
在化验室,想要发现ANCA的主要方法有两种,包括间接免疫荧光和酶联免疫吸附法。在间接免疫荧光法中可以观察到两种类型的ANCA, 一种出现在细胞浆中,称为胞浆型(cytoplasmic ANCA,
cANCA),另一种在细胞核周围,称为环核型(peri-nuclear ANCA, pANCA)。抗体必须与抗原“配对”才能发挥它的作用,cANCA针对的抗原是蛋白酶3(proteinase 3,PR3),pANCA的主要靶抗原之一是髓过氧化物酶(myeloperoxidase,MPO)(图1)。
(二)ANCA会致病吗?
既然ANCA在这一类疾病患者的血液中存在,那么这些抗体是否具有致病的“坏作用”呢?很多临床、实验结果均证实了ANCA的致病作用。
ANCA致病的最直接的证据是一个婴儿在出生后即出现了肺肾综合征,而其母亲为MPA患者,推测是ANCA经胎盘血液循环进入到了婴儿体内,导致婴儿患有同样的疾病。一些临床观察也提示ANCA可能有致病作用。比如研究发现清除患者体内ANCA的治疗(血浆置换)较单纯药物疗法更有利于患者疾病康复。目前认为血浆置换对AAV的治疗作用可能与ANCA的清除有关,暗示ANCA具有致病作用。
对于ANCA致病性的证据,更多的来自于动物实验。很多研究者应用提纯出的抗MPO抗体注射给其他试验小鼠,则可以观察到上述小鼠出现不同程度的血管炎表现。另外一些体外实验证明ANCA可以导致血管损伤,在一些特殊因子的激发下,人体内的中性粒细胞表面出现很多ANCA的抗原,此后,中性粒细胞可以被ANCA进一步激活,导致中性粒细胞发生呼吸爆发和脱颗粒,释放可以损伤血管的物质,这些变化就如同“起火”一样损伤了血管内皮细胞,从而造成血管炎的发生。研究证实了ANCA不仅是ANCA相关血管炎的标志性抗体,更是在发病过程中起了推波助澜的作用。
(三)你知道系统性血管炎吗?
系统性血管炎是以血管的炎症反应为主要病理改变的一类炎性疾病。由于血管的炎性病变导致相应的组织器官出现功能障碍。根据受累血管的大小将系统性血管炎分为三类,即大血管炎、中等血管炎和小血管炎。大血管是指主动脉及供应身体各部分的最大分支(例如供应四肢和头颈部者),中等血管指主要的内脏动脉(如肾、肝、冠状及肠系膜动脉),小血管指小静脉、毛细血管、微小动脉和实质器官内连接微小动脉远端的动脉弓。
1.大血管炎
巨细胞(颞)动脉炎
Takayasu(高安)动脉炎
2.中等血管炎
结节性多动脉炎
Kawasaki(川崎) 病
3.小血管炎
(1)ANCA相关血管炎
肉芽肿性多血管炎
嗜酸粒细胞肉芽肿性多血管炎
显微镜下型多血管炎
(2)免疫复合物型
抗肾小球基底膜病
IgA血管炎
原发性冷球蛋白血症性血管炎
低补体荨麻疹性血管炎
4.多血管血管炎
白塞病
Cogan综合征
5.单一器官血管炎:皮肤白细胞碎裂性血管炎、皮肤动脉炎、原发性中枢神经血管炎
6.系统性疾病相关性血管炎:系统性红斑狼疮血管炎、类风湿关节炎血管炎、类肉瘤血管炎
7.可能病因相关性血管炎:丙肝病毒相关的冷球蛋白血管炎、乙肝病毒相关血管炎、梅毒相关大动脉炎、血清病相关的免疫复合物血管炎、药物相关的免疫复合物血管炎、药物相关的ANCA血管炎、肿瘤相关的血管炎。
在系统性血管炎中,ANCA相关小血管炎与ANCA有着十分密切的关系,下面主要介绍本类疾病。
(四)ANCA相关小血管炎的真相
自1982年发现ANCA以来,人们对于本病的认识不断提高。ANCA相关小血管炎(ANCA-associated vasculitis, AAV)包括肉芽肿性多血管炎、显微镜下多血管炎、嗜酸粒细胞肉芽肿性多血管炎。AAV通常累及全身多系统,发病时主要受累部位是肺脏及肾脏,未经治疗的AAV死亡率较高,目前的治疗方法主要是糖皮质激素联合环磷酰胺,患者的5年存活率可以达到49%-90%。
1.为什么会患上ANCA相关小血管炎?
对于AAV的病因还不完全清楚,但是一些体内及体外的研究提示与以下因素相关。早在20世纪50年代,人们就发现接触硅会导致肾衰竭。到了20世纪80年代,有报道发现接触硅可导致急性肾衰竭。到了20世纪90年代,人们在接触硅的患者血清中检测出了ANCA,从而证实了两者之间的直接关联。由于接触硅而患AAV的患者中,大部分患者为MPA。硅导致AAV的机制目前尚不完全明了,可能与硅颗粒触发了免疫及炎症反应相关。
除了硅颗粒,细菌也是“罪魁祸首”之一,细菌感染的GPA患者在疾病缓解之后更容易复发,其中,金黄色葡萄球菌与GPA关系最为密切。很多GPA患者的上呼吸道中可以找出金黄色葡萄球菌,而鼻腔长期携带金黄色葡萄球菌的患者GPA复发的比例更大。金黄色葡萄球菌引起GPA发病的机制目前尚不明确,可能是其刺激了体内的淋巴细胞并导致ANCA持续产生。
除了上面两个并不常见的致病因素,平时生活中常见的药物也可以诱发ANCA阳性小血管炎,其中以丙基硫氧嘧啶和肼苯哒嗪最多。很多研究表明,患者应用抗甲状腺药物丙基硫氧嘧啶后出现血清ANCA阳性,其中大部分患者是MPO-ANCA阳性。虽然应用PTU的病人可以出现血清ANCA的阳性,但仅有约25%的ANCA阳性病人临床会发生血管炎,发生血管炎的患者血清中抗MPO抗体阳性率、滴度以及亲和力均显著升高。PTU诱发AAV的机制尚不清楚,国外曾有研究认为PTU在进入体内后可能成为MPO的酶的作用底物。
遗传因素在AAV发病中的作用受到研究者们的重视,曾有报道一家族中多名成员发病的报道。很多研究已经证实遗传易感性对于AAV发病以及复发均有影响。目前对于基因多态性在AAV发病中影响的研究涉的基因有很多种。
2. ANCA相关小血管炎的发病机制是什么?
除了上述我们讲到的ANCA在发病过程中存在致病作用外,我们体内的中性粒细胞、补体和淋巴细胞也一起参与到了致病过程中。
由于ANCA的针对的抗原主要贮存于中性粒细胞中,且AAV患者的肾脏中可以找大量中性粒细胞浸润,所以中性粒细胞一直就是众多研究者关注的焦点。体外实验证明,ANCA能够激活中性粒细胞,导致一系列化学反应,就像“起火”一样损伤血管内皮细胞,从而造成血管炎的发生。近期越来越多的实验证明了补体的旁路活化途径在AAV的发病中起了很重要的作用。
T淋巴细胞和B淋巴细胞的致病性贯穿于发病的许多环节包括疾病的诱导期以及血管炎症损伤。在AAV患者中,肾活检组织中可以发现T细胞的浸润,其他的炎症部位也可以发现存在T淋巴细胞。B淋巴细胞可以产生ANCA释放入血,另外B淋巴细胞也可以分泌细胞因子和生长因子。利妥昔单抗是一种CD20单抗,其主要作用于成熟B淋巴细胞,Jones和Stone 等应用利妥昔单抗治疗AAV取得显著疗效,并且可以使患者ANCA滴度降低,因此可以推测在血管炎患者中,B淋巴细胞既可以通过产生抗体发挥作用,也会通过影响T淋巴细胞而发生作用。
3. ANCA相关小血管炎患者是什么样子的?
原发性小血管炎可发生于各个年龄组,特别是中老年,以50-60岁最多。多数病人有上感样前驱症状,常有发热、疲乏和体重下降等非特异性症状。AAV患者最容易出现问题的两个器官是肾脏和肺脏。
(1)肾脏受累表现
在疾病活动期多表现为血尿,可以出现我们肉眼可见的洗肉水样血尿,但尿液异常大多在显微镜下才能发现,可以见到尿液中大量的红细胞,或由红细胞聚集而成的管型;缓解期患者血尿可消失。患者起病急性或隐匿性,通常从局部开始发病,如GPA多首先累及上呼吸道,逐渐进展成伴有肾受累的系统性疾病,肾脏病变可轻重不等。相比较而言,MPA的肾脏受累发生率较高。
(2)肺受累表现
多数ANCA相关性小血管炎患者多有肺受累,很多患者会出现咳嗽、呼吸困难和咯血,重症因肺泡广泛出血发生呼吸衰竭而危及生命。
如果患者出现了咳血,有可能是弥漫性肺泡出血。但如果是GPA患者,则更有可能是肺里结节性病变及局部浸润有关,或者提示GPA病情十分严重,应引起高度重视。胸片或胸部CT可以看到大小不等的结节,甚至空洞样改变。MPA是我国最为常见的ANCA相关性小血管炎。MPA患者肺脏受累的表现也是轻重不一,可以是痰中带血,也可以弥漫性肺泡出血危及生命。EGPA临床表现为过敏如哮喘,即喘息、憋气等表现,肺受累主要表现为肺部浸润影,有时为一过性肺部阴影。
综合以上两点,如果肾脏和肺脏同时出现了问题,就要警惕是不是得了AAV。
(3)上呼吸道受累的表现
GPA患者鼻子也会受到"牵连",可表现为脓性或血性分泌物增多、鼻窦炎、副鼻窦炎甚至鞍鼻等,鼻黏膜活检或手术切除的组织可以发现以小血管炎的特殊表现。患者如果出现声音嘶哑,甚至不能发声,则可能是喉部受累。
(4)其它脏器受累的表现
耳朵受累可表现为听力下降、耳鸣、中耳炎和鼓膜穿孔。眼受累可表现为“红眼病”。有些患者还能出现感觉异常或者严重的神经痛,就是神经系统受累。皮肤受累可表现为像“蜘蛛网一样”的网状青斑、紫癜或荨麻疹等。消化道受累常表现为不易愈合的胃或十二指肠溃疡,还可表现为胃肠道出血、腹痛、腹泻,甚至可能发生肠穿孔导致腹膜炎和败血症。
4.诊断
国际上尚无统一、公认的临床诊断标准。目前应用最为广泛的是1990年美国风湿病学会的分类诊断标准和1994年Chapel Hill系统性血管炎命名国际会议所制定的标准。1994年Chapel Hill系统性血管炎命名国际会议所制定的血管炎名称和定义,无疑是目前应用最为广泛的分类诊断标准。传统理论认为血清ANCA的类型对于界定GPA和MPA有一定帮助,例如cANCA/抗PR3抗体与GPA密切相关,pANCA/抗MPO抗体与MPA密切相关,但是来自北京大学第一医院的研究显示国人的GPA是以pANCA/抗MPO抗体阳性者为主,提示不同种族、不同环境的AAV患者的血清学标志可能存在很大的差异。
ANCA是国际通用的原发性小血管炎的特异性血清学诊断工具, cANCA合并抗PR3抗体阳性和pANCA合并抗MPO抗体阳性用于诊断AAV的特异性均可以达到99%。
AAV一旦全身多系统受累则进展迅速,及时给予免疫抑制治疗可以明确地改善患者的预后。但是临床上目前面临的一个重要问题是长期应用糖皮质激素和细胞毒药物如环磷酰胺也可以引起严重的副作用。因此,临床上需要有明确的指标来判断病情的活动以指导治疗方案的选择。
5.治疗
目前AAV治疗的很多方面已形成一致看法。AAV的治疗分为诱导缓解、维持缓解的治疗。诱导缓解期治疗是应用糖皮质激素联合细胞毒性药物,对于重症患者应采取必要的抢救措施,包括大剂量甲基强的松龙(MP)冲击和血浆置换。维持缓解期主要是长期应用免疫抑制药物伴或不伴小剂量激素治疗。
(1)诱导缓解期的治疗
国内外研究均表明糖皮质激素联合细胞毒药物,特别是环磷酰胺可明显提高患者生存率。
目前,糖皮质激素联合环磷酰胺仍然是治疗AAV的标准方案,能够使90%以上的病人临床显著缓解。强的松(龙)初期治疗为1mg/kg•day,4-6周,病情控制后可逐步减量 。环磷酰胺口服剂量一般为2mg/kg•d,持续3-6月。常用方法为静点0.75 g/m2,每月一次,连续六个月。环磷酰胺静脉冲击与口服治疗的诱导缓解率和复发率均相似,但由于静脉冲击疗法的环磷酰胺累计剂量小,因此感染等不良反应的发生率显著偏低。对于老年患者和肾功能不全者,环磷酰胺应酌情减量。有重要脏器活动性受损的患者,诱导治疗初期可以应用甲基强的松龙(MP)冲击治疗,每日1次或隔日一次,3次为一个疗程,继之以口服糖皮质激素治疗。
血浆置换,其基本原理是利用血细胞分离机,在体外将患者的血液分离成血浆和血细胞成分(红细胞、白细胞、血小板)。然后弃去含有害致病物质的血浆,用等量的置换液代替,再把血细胞成分和血浆置换液一起回输到患者的体内。更适用于当AAV患者合并抗肾小球基底膜抗体、严重肺出血和严重急性肾衰竭者。既往研究发现,血浆置换较MP冲击治疗更有利于患者肾功能的恢复。
(2)维持缓解期的治疗
诱导缓解结束之后就进入维持缓解治疗,其目的是减少患者的复发。鉴于长期应用环磷酰胺的副作用,在进入维持缓解治疗之后,应选用其它副作用较小的免疫抑制剂来替代环磷酰胺。维持缓解治疗可供选择的免疫抑制剂较多,列举如下。
①硫唑嘌呤(AZA):硫唑嘌呤是在维持缓解治疗阶段能够替代环磷酰胺证据最强的药物,应用硫唑嘌呤可以替代环磷酰胺用于系统性小血管炎的维持缓解治疗。
②氨甲喋呤:氨甲喋呤是AAV维持缓解治疗的又一重要的可选方案。目前推荐氨甲喋呤治疗仅限于Scr<177μmol/L者,且治疗期间应注意补充叶酸。
③吗替麦考酚酯:吗替麦考酚酯用与维持缓解治疗具有副作用较小的优点,目前吗替麦考酚酯多作为二线方案使用。
④来氟米特:来氟米特用于AAV维持缓解治疗的研究始于2004年,曾有研究结果表明,来氟米特组较甲氨喋呤组复发较少但副作用较多,包括高血压、白细胞减少等。
此外,研究证实GPA患者鼻部携带金黄色葡萄球菌是GPA复发的重要原因,研究显示应用复方新诺明清除金黄色葡萄球菌可显著减少GPA的复发。应用剂量为磺胺甲恶唑800mg和甲氧苄氨嘧啶160mg,每周3次。鼻部局部应用莫匹罗星(Mupirocin)也有较好的清除金黄色葡萄球菌的作用,还可以用于肾脏受损和无法应用复方新诺明的GPA病人。
(3)难治性血管炎的治疗
难治性血管炎是指对传统的糖皮质激素联合环磷酰胺治疗无效或不能耐受者。近年来,有学者尝试将吗替麦考酚酯应用于不能耐受环磷酰胺的患者并取得成功,在一部分经典治疗无效或对经典治疗不能耐受而病情又不断进展的患者中,可以用单克隆抗T淋巴细胞抗体或抗胸腺细胞球蛋白(ATG)使淋巴细胞耗竭来诱导疾病缓解,例如抗CD4和抗CD52人源性的单克隆抗体 。针对B淋巴细胞的药物例如利妥昔单抗(Rituximab)。上述这些药物近年来的相关研究报道也越来越多。
6.预后
由于AAV肾脏受累则进展迅速至肾衰竭、肺脏受累可以发生大量肺出血而危及生命,因此本病未经治疗者预后极差,90%患者在1年内死亡。应用糖皮质激素和环磷酰胺治疗有确切疗效,可以使患者的5年生存率达到80%。随着糖皮质激素和免疫抑制剂的广泛应用,AAV的活动性往往能够得到很有效的控制,但治疗所带来的副作用不容忽视,继发感染特别是肺部感染已经成为患者重要的死亡原因之一,因此在治疗时应加强监测,以减少治疗所造成的不良反应。
图1. 免疫荧光下不同ANCA
( 本章作者:赵明辉
常冬元 陈旻)
版权所有 © 北京大学人民医院风湿免疫研究所
技术支持:优河马