2020年是类风湿关节炎(RA)临床和基础研究迅速发展的一年,从新的发病机制到早期诊治方法和策略,类风湿关节炎领域都取得了一系列重要进展。应《NEJM医学前沿》邀请,北京大学人民医院临床免疫中心栗占国教授盘点了2020年度类风湿关节炎主要研究。
NEJM医学前沿由嘉会医学研究和教育集团(JMRE)与《新英格兰医学杂志》(NEJM)联手打造。本文是2020年度盘点第8篇。
栗占国*,李茹
北京大学人民医院临床免疫中心/风湿免疫科
*通讯作者
治疗策略及方案
一、美国风湿病学会治疗推荐意见(草案)发布
2020年11月,美国风湿病学会(ACR)年会上发布了新版类风湿关节炎(RA)治疗推荐意见(草案)。该草案包括改善病情抗风湿药(DMARD)初治的低疾病活动度和中高疾病活动度RA患者治疗选择、甲氨蝶呤使用、未达标患者治疗建议、减停药以及特殊人群用药六个方面的推荐意见:
1. 既往未用DMARD的中高疾病活动度患者
(1)DMARD单药治疗:甲氨蝶呤优先于羟氯喹或柳氮磺吡啶(强烈推荐);甲氨蝶呤优先于来氟米特(有条件推荐);甲氨蝶呤优先于生物DMARD或靶向合成DMARD单药治疗(强烈推荐)。
(2)DMARD单药与联合治疗:甲氨蝶呤单药优先于羟氯喹或柳氮磺吡啶(强烈推荐);甲氨蝶呤单药优先于传统合成DMARD二联或三联(有条件推荐);甲氨蝶呤单药优先于甲氨蝶呤联合TNF抑制剂(有条件推荐);甲氨蝶呤单药优先于甲氨蝶呤联合非TNF抑制剂生物MDARD或合成DMARD(强烈推荐)。
(3)糖皮质激素:DMARD不联合短疗程糖皮质激素(<3个月)优先于DMARD联合短疗程糖皮质激素(有条件推荐);DMARD不联合长疗程糖皮质激素(>3个月)优先于DMARD联合长疗程糖皮质激素(强烈推荐)。
2. 既往未用DMARD的低疾病活动度患者
羟氯喹优先于其他传统合成DMARD(有条件推荐);柳氮磺吡啶优先于甲氨蝶呤(有条件推荐);甲氨蝶呤优先于来氟米特(有条件推荐)。
3. 甲氨蝶呤使用
起始治疗时,口服优先于皮下注射(有条件推荐);如口服不耐受,分次服用,或皮下注射,或增加叶酸剂量,优先于转换为其他DMARD(有条件推荐);如口服给药未达标,转换为皮下注射甲氨蝶呤优先于加用或转换为其他DMARD(有条件推荐)。
4. 未达标患者治疗建议
(1)达标治疗:如既往未用过生物或靶向合成DMARD,达标治疗优先于常规治疗(强烈推荐);如≥1种生物或靶向合成DMARD无效,达标治疗优先于常规治疗(有条件推荐);作为最低初始治疗目标,低疾病活动度优先于缓解(有条件推荐)。
(2)糖皮质激素使用:需要糖皮质激素维持达标的患者,加用/转换DMARD优先于继续使用糖皮质激素(有条件推荐);接受DMARD治疗而未达标的患者,加用/换用DMARD,联合或不联合关节腔注射糖皮质激素,优先于单独关节腔注射糖皮质激素(有条件推荐)。
(3)DMARD转换:已达到甲氨蝶呤最大耐受剂量的患者,加用生物或靶向合成DMARD,优先于加用羟氯喹和柳氮磺吡啶(有条件推荐);已应用生物或靶向合成DMARD的患者,转换为不同类别的生物或靶向合成DMARD优先于转换为同类别药物(有条件推荐)。
5. 药物减量
(1)如达标已至少6个月考虑减停药物:按当前剂量维持使用所有DMARD优先于减量(有条件推荐);减少剂量优先于逐渐减停(有条件推荐);逐渐减停优先于突然停药(有条件推荐)。
(2)如患者要求停药:接受三联治疗的患者,逐渐减停柳氮磺吡啶优先于羟氯喹(有条件推荐);接受甲氨蝶呤联合生物或靶向合成DMARD治疗的患者,逐渐减停甲氨蝶呤优先于生物或靶向合成DMARD(有条件推荐)。
6. 特殊人群
(1)合并皮下结节:结节合并中高疾病活动度患者,甲氨蝶呤优先于其他DMARD(有条件推荐);甲氨蝶呤治疗仍存在进展性结节的患者,更换成非甲氨蝶呤的DMARD优先于继续使用甲氨蝶呤(有条件推荐)。
(2)肺部疾病合并中高度疾病活动度:伴发的轻度且稳定的气道或实质性肺病,甲氨蝶呤优先于其他DMARD(有条件推荐)。
(3)合并心力衰竭:纽约心功能分级Ⅲ或Ⅳ级且传统合成DMARD无效的患者,非TNF抑制剂的生物或靶向合成DMARD优先于TNF抑制剂(有条件推荐);使用TNF抑制剂出现心衰的患者,转换为非TNF抑制剂的生物或靶向合成DMARD,优先于继续使用TNF抑制剂(有条件推荐)。
(4)淋巴增殖性疾病合并中高度疾病活动度:利妥昔单抗优先于其他生物或靶向合成DMARD(有条件推荐)。
(5)合并乙型肝炎:HBcAb阳性患者开始利妥昔单抗治疗,或HBsAg阳性患者开始任何生物或靶向合成DMARD治疗时,给予预防性抗病毒治疗(强烈推荐);HBcAb阳性/HBsAg阴性患者开始非利妥昔单抗的生物或靶向合成DMARD治疗时,密切监测乙肝情况(有条件推荐)。
(6)合并非酒精性脂肪性肝病:初始、中高疾病活动度、肝功能正常、无进展性纤维化的患者,甲氨蝶呤优先于其他DMARD(有条件推荐)。
(7)合并持续性低免疫球蛋白血症,不伴感染:使用利妥昔单抗且已达标的患者,继续使用利妥昔单抗优先于转换为不同的生物或靶向合成DMARD(有条件推荐)。
(8)既往12个月内严重感染:中高疾病活动度的患者,加用/转换DMARD优先于开始/增加糖皮质激素剂量(有条件推荐);传统合成DMARD单药治疗仍有中高疾病活动度的患者,加用传统合成DMARD优先于开始生物或靶向合成DMARD治疗(有条件推荐)。
(9)合并非结核分枝杆菌肺病:糖皮质激素减量至最小剂量,优先于继续维持相同剂量(有条件推荐);传统合成DMARD单药治疗仍存在中高疾病活动度的患者,传统合成DMARD优先于生物或靶向合成DMAR(有条件推荐);传统合成DMARD治疗后仍存在中高疾病活动度的患者,阿巴西普优先于其他生物或靶向合成DMARD(有条件推荐)。
与2015年ACR指南相比,新版推荐意见增加了甲氨蝶呤使用以及合并皮下结节、肺病、非酒精性脂肪性肝病、持续性低免疫球蛋白血症、非结核分枝杆菌肺病等特殊情况的处理建议,在不同疾病活动度起始DMARD单药治疗选择、DMARD减量时机和顺序等方面提出了不同的意见。该推荐意见尚未正式发表。
激素在RA的治疗中是一把双刃剑,既有很好的治疗作用,又有可能导致感染、骨质疏松、高血糖、胃肠道反应等副作用。如何在RA患者合理应用激素一直倍受关注,是临床热点问题。
2020年,Burmester等在Lancet发表了名为SEMIRA的多中心、随机、双盲、平行对照临床试验[1]。来自6个国家39个研究中心的259例患者纳入了研究。所有患者均接受托珠单抗和激素治疗24-48周,其中达到基于红细胞沉降率的28关节疾病活动度评分(DAS28-ESR)<3.2维持4-6周且泼尼松剂量5 mg/d至少4周的低疾病活动度RA患者随机分为两组,一组维持泼尼松治疗,另一组逐渐减停泼尼松。结果显示,维持小剂量激素组患者24周时DAS28-ESR平均下降了0.08,而激素减停组DAS28-ESR增加了0.54。有2/3患者成功减停激素,而维持小剂量激素治疗控制疾病活动度更好。本研究样本量小,对小剂量激素维持治疗相关感染等不良反应的分析不够,需进一步的大样本研究。
2020年,Ann Intern Med报道了一项纳入216,159例RA患者的大样本回顾性队列研究[2],结果显示,小剂量激素与重症感染风险密切相关,即使小于5 mg/d的激素量也明显增加感染风险[2]。该结论与以往的大多数研究观点一致。
因此,临床上小剂量激素治疗RA还应充分评估疗效和风险以实现个体化选择,尽可能在短期内达到激素减量和停药仍然是RA治疗的目标。
2020年7月,北京大学人民医院本课题组完成了一项5年真实世界纵向队列研究,分析了持续积极治疗对RA长期缓解的影响[3]。研究纳入RA患者541例,共2588次复诊。结果显示,按照DAS28-ESR、DAS28-CRP和CliDR标准,三种不同治疗方案的5年累积缓解率明显不同,以PRINT方案为主的积极治疗组患者累积缓解率显著高于其他组。多因素分析提示,应用积极治疗的PRINT方案是RA缓解的独立相关因素。
因此,临床上不应在RA患者症状好转后即行减药或停药,而需要持续治疗较长时间,以利病情持续缓解,改善预后。该结论与2020年 ACR更新的RA治疗推荐意见一致。
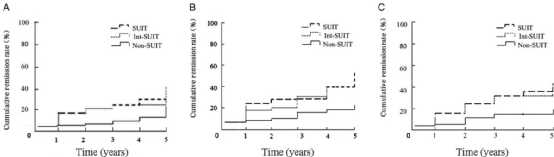
图1. 持续积极治疗的RA患者5年累积缓解率明显高于非持续积极治疗者[3]
当RA患者达到临床缓解后,先减传统DMARD还是先减生物制剂一直受到临床关注。荷兰的一项为期2年、发表于Ann Rheum Dis的随机对照临床试验研究了这一问题[4]。该研究纳入接受传统DMARD和TNF抑制剂达到缓解的189例患者,随机分为两组,一组先减传统DMARD,另一组先减TNF抑制剂。结果显示,研究过程中两组的维持缓解率、关节功能、影像学评分以及不良反应发生率均无明显统计学差异,而先减传统DMARD组的无药缓解率稍高于先减生物制剂组(P=0.07)。
但是,这项研究为期2年,能达到无药缓解的RA患者仅29例,样本量和随访时间存在局限性,而且临床决策时还需考虑患者依从性、经济状况等因素。
新型药物
近年来,小分子靶向药物在RA治疗中的应用快速进展,新的小分子靶向药物研究陆续发表,为这些新药的临床应用进一步积累了临床数据。
2020年10月,Rubbert-Roth等在《新英格兰医学杂志》(NEJM)发表了一项关于乌帕替尼(upadacitinib)和阿巴西普治疗RA的3期临床试验[5]。该研究纳入既往接受过生物制剂治疗但应答不佳的RA患者612例,随机给予乌帕替尼或阿巴西普治疗。结果显示,乌帕替尼组第12周的DAS28评分较基线下降2.52分,阿巴西普组下降2分,两组有明显统计学差异。但乌帕替尼组不良事件较多,主要为肝酶异常,有2例发生静脉血栓栓塞事件。
2020 ACR年会公布的一项关于非格替尼(filgotinib)的3期临床试验比较了非格替尼100 mg/d、200 mg/d和阿达木单抗(40 mg q2w)的疗效[6]。研究纳入甲氨蝶呤疗效欠佳的活动期RA患者1755例,结果显示,治疗52周时的DAS28缓解率在非格替尼200 mg组和100 mg 组分别为54%和43%,而阿达木单抗组为46%。非格替尼200 mg组疗效优于阿达木单抗。
在新的欧洲抗风湿病联盟(EULAR)和ACR指南中,小分子靶向药在RA治疗中均被放在了与生物DMARD相当的地位。随着临床试验和真实世界研究取得更多进展,小分子靶向药的应用将更加规范和个体化,从而更好地改善RA患者预后。
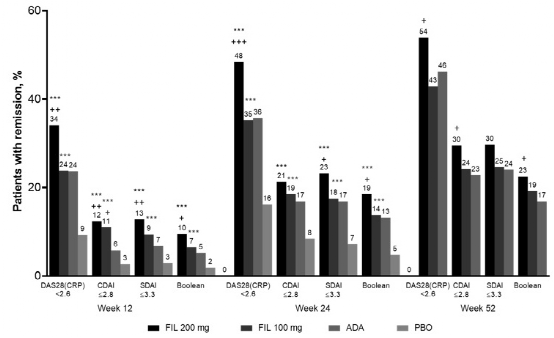
图2. 非格替尼200 mg组疗效优于阿达木单抗[6]
诊断方法
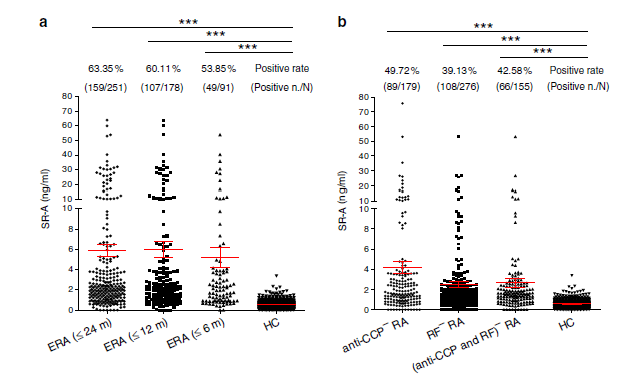
2020年,北京大学人民医院本团队在Nature Commun发表论文,发现Scavenger receptor-A(SR-A)是一种新的RA致病性分子和生物标志物[7]。SR-A在RA患者中敏感性66.41%,特异性91.45%,是血清阴性及早期RA的标志物,阳性率分别为42.58%和53.85%。同时,课题组还发现,SR-A可以促进关节炎小鼠发病,加重关节炎症和骨侵蚀,而靶向抑制SR-A可以缓解关节炎小鼠的症状,为RA免疫治疗提供了新的靶点。
图3. SR-A在早期和血清阴性RA中的阳性率分别为53.85%和42.58% [7]
2020年,Kelmenson等在Arthritis Rheumatol发表文章,对临床前RA的自身抗体进行分析,发现IgG型ACPA抗体最早出现阳性,先于RA发病17.9年,IgA和IgM型类风湿因子(RF)分别出现于RA发病前14.2年和7.2年,IgA型ACPA出现于发病前6.2年,而IgM型ACPA和IgA型RF在发病前5年出现[8]。这些低滴度自身抗体一般数年保持稳定,在起病前抗体滴度出现快速上升,其中抗体产生较早的患者更容易合并肺间质病变和Sicca综合征。
瑞典卡罗林斯卡医学院的Sahlström等发现,ACPA与抗修饰蛋白抗体(AMPA)存在多重反应,可识别氨甲基化修饰蛋白和乙酰化修饰蛋白。瓜氨酸/氨甲酰/乙酰化赖氨酸的多重反应在RA发病机制中的作用很值得进一步研究[9]。此外,美国威斯康辛-麦迪逊大学Zheng等的研究发现,RF和抗CCP抗体存在共同的抗原表位,是对RA发病机制的新认识[10]。
发病机制
RA致病中的免疫细胞和分子机制研究在2020年取得突破性进展,这些重要发现为RA精准诊断、靶向治疗开拓了新的领域。
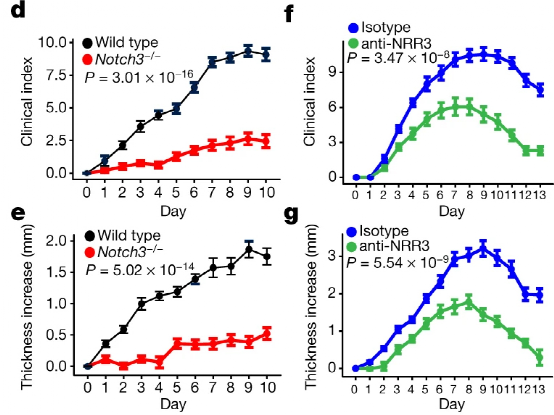
Wei等研究了CD90+滑膜衬里下层成纤维细胞致炎的分子机制。这项发表于Nature的研究[11]发现,NOTCH3在CD90+滑膜衬里下层成纤维细胞分化中发挥重要作用,在活动性RA滑膜成纤维细胞中这一通路相关基因表达明显上调,抑制NOTCH3信号可以减轻小鼠关节炎。
图4. 抑制Notch3信号可以减轻小鼠关节炎临床评分(d,f)和足爪厚度(e,g)[11]
洛克菲勒大学的研究者发现, CD45-CD31-PDPN+前炎症性间充质细胞(PRIME细胞)是RA复发的关键炎性细胞[12]。这项发表在NEJM的研究通过对复发前RA患者血样进行RNA测序分析,发现这种PRIME细胞可以在患者复发前1周出现,随后向滑膜迁移,导致局部炎性改变。这种新细胞可能在RA致病机制中发挥了重要作用,有可能为RA病情监测提供新的手段。
北京协和医院张烜课题组对RA CD4+ T细胞TCRβ进行了分析,发现效应记忆T细胞和Th17细胞存在高频克隆扩增,提示这两种细胞亚群可能存在相关性。而且这些相似克隆与RA患者的CRP、ESR和DAS28具有显著相关性,在RA发病过程中具有重要意义。这项研究发表于J Autoimmun[13]。课题组还研究了基于RA自身抗原肽的嵌合抗原受体T细胞(CAR T)新技术,并利用小鼠胶原性关节炎(CIA)模型和体外实验,证明这种CAR T可抑制RA自身反应性B细胞,从而发挥靶向治疗作用[14]。该研究发表于Ann Rheum Dis。
2020年,中山大学郑颂国等的研究在Science Advances发表。该研究比较了诱导性调节性T细胞(iTreg)和天然Treg(nTreg)对RA滑膜细胞的调节作用,发现iTreg可抑制CIA滑膜成纤维细胞的增殖、侵袭和炎性因子产生,而nTreg不具有这一功能[15]。研究提示,调控iTreg细胞亚群可能成为新的RA治疗手段。
作者介绍

栗占国,主任医师,教授,北京大学人民医院临床免疫中心主任,北京大学医学部风湿免疫学系主任,国家杰出青年基金获得者。中国免疫学会临床免疫分会主任委员,国际风湿病联盟(ILAR)和亚太风湿病联盟(APLAR)前主席,WHO骨与肌肉疾病委员会(ICC)委员。《中华风湿病学杂志》总编,Clin Rheum,IJRD,Nat Rev Rheum和Lancet Rheum等杂志副主编或编委。长期从事风湿免疫病临床及诊治方法的研究,发现了新的类风湿关节炎致病分子及其机制,建立的免疫诊治方法和方案已用于临床。在Nat Med, Immunity,Science,Lancet Rheum及Cell H&M等发表SCI论文280余篇。主编/译《类风湿关节炎》,《风湿免疫学高级教程》,《凯利风湿病学》等专著20余部。
参考文献
1. Burmester GR, Buttgereit F, Bernasconi C, et al. Continuing versus tapering glucocorticoids after achievement of low disease activity or remission in rheumatoid arthritis (SEMIRA): a double-blind, multicentre, randomised controlled trial. Lancet 2020;396:267-76.
2. George MD, Baker JF, Winthrop K, et al. Risk for serious infection with low-dose glucocorticoids in patients with rheumatoid arthritis: a cohort study. Ann Intern Med 2020;173:870-8.
3. Cai YM, Li R, Ye H, et al. Effect of sustained intensive therapy with disease modifying anti-rheumatic drugs in rheumatoid arthritis: a 5-year real-world consecutive study. Chin Med J (Engl) 2020;133:1397-1403.
4. van Mulligen E, Weel AE, Hazes JM, et al. Tapering towards DMARD-free remission in established rheumatoid arthritis: 2-year results of the TARA trial. Ann Rheum Dis 2020;79:1174-81.
5. Rubbert-Roth A, Enejosa J, Pangan AL, et al. Trial of upadacitinib or abatacept in rheumatoid arthritis. N Engl J Med 2020;383:1511-21.
6. Combe B, Kivitz A, Tanaka Y, et al. Efficacy and safety of filgotinib for patients with rheumatoid arthritis with inadequate response to methotrexate: FINCH 1 52-week results. ACR 2020. Abstract P0208.
7. Hu F, Jiang X, Guo C, et al. Scavenger receptor-A is a biomarker and effector of rheumatoid arthritis: A large-scale multicenter study. Nat Commun 2020;11:1911.
8. Kelmenson LB, Wagner BD, McNair BK, et al. Timing of elevations of autoantibody isotypes prior to diagnosis of rheumatoid arthritis. Arthritis Rheumatol 2020;72: 251-61.
9. Sahlström P, Hansson M, Steen J, et al. Different hierarchies of anti-modified protein autoantibody reactivities in rheumatoid arthritis. Arthritis Rheumatol 2020;72:1643-57.
10. Zheng Z, Mergaert AM, Fahmy LM, et al. Disordered antigens and epitope overlap between anti-citrullinated protein antibodies and rheumatoid factor in rheumatoid arthritis. Arthritis Rheumatol 2020;72:262-72.
11. Wei K, Korsunsky I, Marshall JL, et al. Notch signalling drives synovial fibroblast identity and arthritis pathology. Nature 2020;582: 259-64.
12. Orange DE, Yao V, Sawicka K, et al. RNA identification of PRIME cells predicting rheumatoid arthritis flares. N Engl J Med 2020; 383: 218-28.
13. Jiang X, Wang S, Zhou C, et al. Comprehensive TCR repertoire analysis of CD4(+) T-cell subsets in rheumatoid arthritis. J Autoimmun 2020; 109: 102432.
14. Zhang B, Wang Y, Yuan YS, et al. In vitro elimination of autoreactive B cells from rheumatoid arthritis patients by universal chimeric antigen receptor T cells. Ann Rheum Dis 2021; 80:176-84.
15. Yang SJ, Zhang XM, Chen JR, et al. Induced, but not natural, regulatory T cells retain phenotype and function following exposure to inflamed synovial fibroblasts. Sci Adv 2020;6:eabb0606.
本文由嘉会医学研究和教育集团(JMRE)与《新英格兰医学杂志》(NEJM)联手打造的《NEJM医学前沿》翻译、编写或约稿。中译全文及所含图表等由NEJM集团独家授权。如需转载,请留言或联系nejmqianyan@nejmqianyan.cn。未经授权的翻译是侵权行为,版权方保留追究法律责任的权利。

 风湿消息
风湿消息