 风湿消息
风湿消息
栗占国教授:2021风湿免疫重要研究进展、指南更新
NEJM医学前沿》邀请北京大学人民医院临床免疫中心栗占国教授团队梳理了2021年风湿免疫领域在基础和临床研究方面的重要进展,各学会发布的风湿免疫病治疗指南和共识,以及待解决的问题。
《NEJM医学前沿》由嘉会医学研究和教育集团(J-Med)与《新英格兰医学杂志》(NEJM)联手打造。与过去三年一样,我们将陆续推出各重要疾病领域临床研究盘点,敬请期待。
贾园,栗占国*
北京大学人民医院临床免疫中心/风湿免疫科
*通讯作者
2021年刚刚过去,一年来风湿免疫领域在基础和临床研究方面均取得了重要进展,本文对2021年发表的主要临床研究及治疗推荐和共识进行归纳,供同道们参考。
1. 类风湿关节炎患者的免疫特征是个体化治疗的依据
2021年,Lancet发表了Humby等的多中心、开放标签临床4期随机对照试验,试验为期48周,目的为比较托珠单抗和利妥昔单抗在通过滑膜B细胞状态进行分层、对肿瘤坏死因子(TNF)抑制剂反应不佳的类风湿关节炎(RA)患者中的疗效[1]。患者在治疗前行滑膜活检,在组织学上被分类为B细胞丰或寡,并在RNA测序后通过B细胞分子特征重新分类。患者随机分配接受托珠单抗和利妥昔单抗治疗。结果显示,在组织学上分类为寡B细胞的RA患者中,托珠单抗和利妥昔单抗的疗效没有显著差异,而在滑膜活检RNA测序显示寡B细胞的RA患者中,托珠单抗组有更高的治疗反应,临床疾病活动度降低³50%的患者比例为63%,而利妥昔单抗组仅有36%。该研究结果提示,滑膜组织免疫学等特征与临床治疗反应更相关。因此,针对不同RA患者免疫及炎性改变选择个体化用药是RA缓解的关键。
2. ACR更新类风湿关节炎指南,缓解病情抗风湿药物指导意见更为具体化
2021年6月美国风湿病学会(ACR)更新了2021RA治疗指南,在达标治疗、缓解病情抗风湿药物(DMARDs)的优先应用顺序、减停方案以及激素的合理应用方面提出了44条推荐建议[2]。具体内容如下:
DMARDs治疗的启动
甲氨蝶呤的使用
治疗方案的调整
DMARDs的减量/停药
另外,除了更新2015版指南中提到有严重感染史患者及合并心功能不全患者的用药建议外,还增加了对皮下结节、肺部疾病、淋巴组织增生性疾病、乙肝感染、非酒精性脂肪肝、无感染的持续性低丙种球蛋白血症以及非结核分枝杆菌性肺病人群的用药建议。
3. 半量csDMARDs维持治疗较稳定剂量更易复发
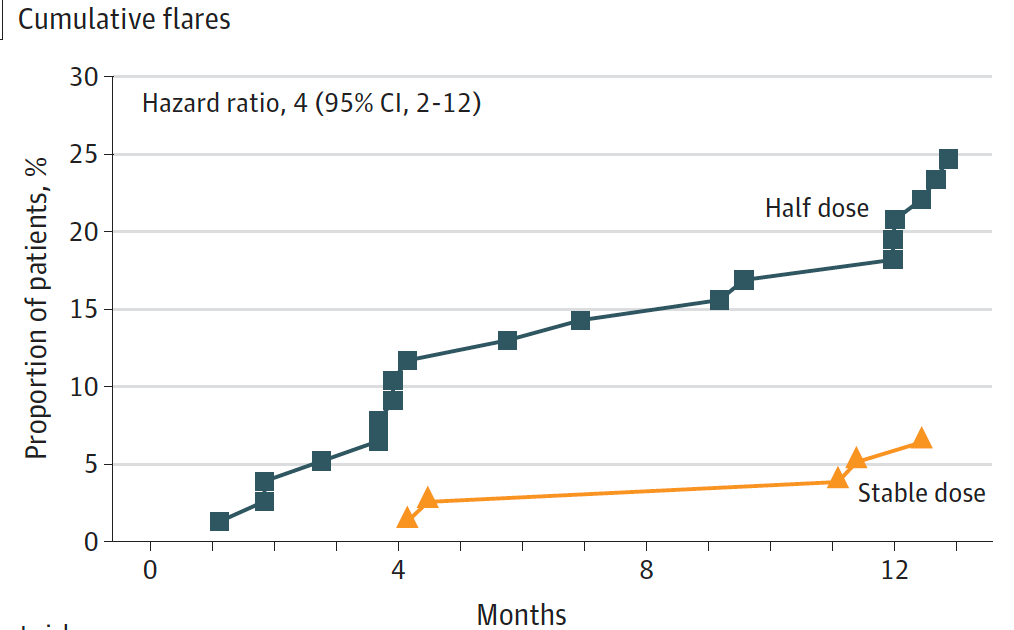
RA患者病情缓解后是否可以减停、如何减停DMARDs药物是临床上的热点问题。JAMA上发表了Lillegraven等的ARCTIC REWIND研究,将160名处于临床缓解期的RA患者随机分到稳定剂量和半剂量csDMARDs治疗组,随访12个月,结果显示半剂量组有25%(19例)的患者出现疾病活动,而稳定剂量组仅有6%(5例),证明处于临床缓解期的RA患者应用半剂量csDMARDs维持治疗相比稳定剂量更易复发[3]。该研究为缓解期患者的巩固治疗策略提供了参考。
半量组与稳定剂量组的累积复发风险比较
另外一项发表于Lancet Rheumatol上的多中心、前瞻性、随机对照3期试验(RETRO)也比较了病情已稳定缓解的RA患者使用DMARDs药物维持、减量(50%)和逐渐停用之间的差别,主要终点是12个月时达到持续DAS28-ESR(基于红细胞沉降率的28个关节疾病活动评分)缓解且无复发的患者比例[4]。结果表明,维持剂量组12个月的缓解率为81.2%,减量组为58.6%,停药组为43.3%(P=0.0005)。与维持剂量组相比,减量组的复发危险比为3.02(95%CI,1.69~5.40;P=0.0003),停药组为4.34(95%CI,2.48~7.60;P<0.0001)。大多数复发患者在重新接受原剂量DMARDs后重新达到病情缓解。此项研究提示,有约一半患者的确可在减量或停药的情况下达到持续缓解状态。但与维持剂量相比,减少或停用DMARDs会显著增加复发风险。
4. 亚太地区类风湿关节炎患者临床缓解率仍低,需进一步规范用药
北京大学人民医院牵头对亚太风湿病学会联盟(APLAR)国家及地区17个中心的RA患者缓解率开展了真实世界多中心、大样本横断面调查研究。结果显示,亚太地区的RA临床缓解率较低,RA患者仅有62.3%、35.5%、30.8%、26.5%、24.7%和17.1%分别达到DAS28-CRP(基于C反应蛋白的28个关节疾病活动评分)、DAS28-ESR、CDAI(临床疾病活动指数)、SDAI(简化疾病活动指数)、Boolean和CliDR缓解标准[5]。对低缓解率的原因进行分析,结果显示,在亚太地区,csDMARDs仍是主要用药,甲氨蝶呤使用剂量不足(18.9%的患者应用剂量<10mg)以及生物/靶向合成DMARDs(b/tsDMARDs)的低使用率(17.9%)与缓解率较低有关。而男性、年轻患者、合并症少、较少系统性受累、应用生物制剂以及不长期使用GC的RA患者,缓解率更高,预后更好。本研究为RA患者缓解现状以及缓解相关因素提供了数据,对RA的规范化治疗有重要意义。
1. 血小板DNA释放与系统性红斑狼疮的自身免疫发生密切相关
拉瓦尔大学和加拿大魁北克大学拉瓦尔研究中心的研究人员合作,在Sci Transl Med发表了论文,指出DNA存在于血小板线粒体中,血小板在系统性红斑狼疮(SLE)中可能起到关键作用[6]。研究者分析了74位SLE患者的血液样本,发现血小板是细胞外DNA的来源之一。当血小板被激活后,释放线粒体及其DNA,被机体识别并产生相应抗体。如果阻止血小板激活,可以减少线粒体和线粒体DNA的释放,将有助于减轻SLE的自身免疫反应。该研究对于理解疾病机制提供了试验依据,也为SLE的免疫治疗提供了新靶点。
2. 首个亚太地区系统性红斑狼疮治疗的推荐意见发表
2021年7月,亚太地区风湿病联盟(APLAR)制定了首个SLE治疗推荐意见,发表在Int J Rheum Dis,其包括4条总体原则、10条一般治疗策略以及20条主要器官受累管理建议[7]。以病情缓解或低疾病活动度为目标,减少器官损伤、保障患者长期生存和提高生活质量。所有SLE患者应常规使用羟氯喹(有禁忌证者除外)。关于GC,建议应使用最小有效剂量。吗替麦考酚酯(MMF)或标准剂量环磷酰胺联合中等剂量GC用于活动性狼疮肾炎的诱导治疗方案(Ⅲ、Ⅳ、Ⅴ型),且建议维持治疗时间≥5年以防复发。中-高剂量GC联合环磷酰胺是严重神经精神性狼疮及严重或危及生命的SLE的一线治疗。另外,建议还指出,鉴于治疗的副作用,免疫抑制治疗不应仅根据血清学活动而启用或调整。
3. 伏环孢素(voclosporin)可改善狼疮肾炎患者治疗应答率,成为狼疮肾炎治疗新选择
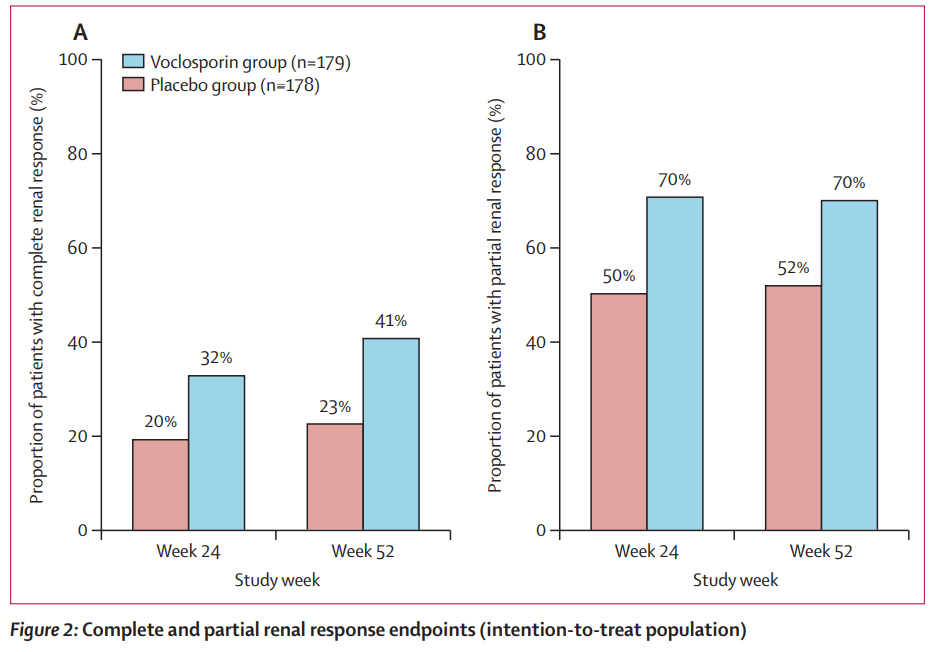
2021年,Lancet发表了伏环孢素的随机、双盲、安慰剂对照、多中心3期临床试验,试验对比了179例应用伏环孢素的狼疮肾炎患者和178例对照组患者在用药第52周时的应答情况,两组患者都应用了MMF和快速减量的低剂量GC作为背景治疗[8]。试验结果显示,应用伏环孢素治疗的患者41%(73例)出现了完全应答,而对照组为23%(40例),表明伏环孢素可提高狼疮肾炎患者的完全应答率,且与对照组具有相似的安全性。
伏环孢素组与安慰剂对照组比较狼疮肾炎患者完全和部分应答率
4. 难治性狼疮肾炎患者给予低剂量IL-2治疗有效且安全
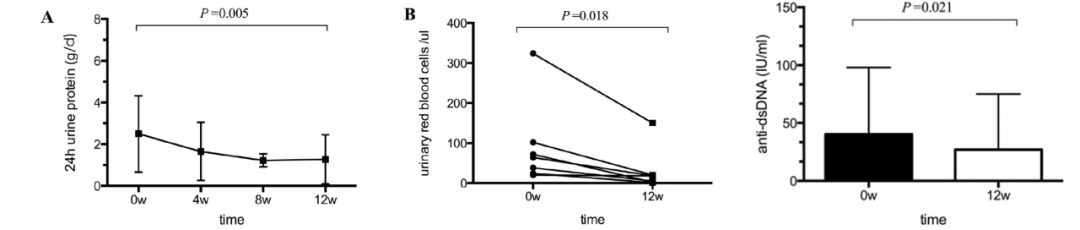
张霞等发表于Rheumatol Ther的一项研究观察了10名经两种以上的传统免疫抑制剂治疗疗效欠佳的难治性狼疮肾炎(LN)患者在加用低剂量IL-2治疗12周后的各项临床指标,结果显示全部患者的尿蛋白水平降低,并伴尿红细胞下降及血双链DNA水平下降[9]。证明了低剂量IL-2在难治性狼疮肾炎治疗中的有效性和安全性,可作为靶向性生物治疗药物。
低剂量IL-2治疗后24小时尿蛋白定量、尿红细胞计数以及血清dsDNA水平下降
5. T细胞疗法有望治愈难治性系统性红斑狼疮
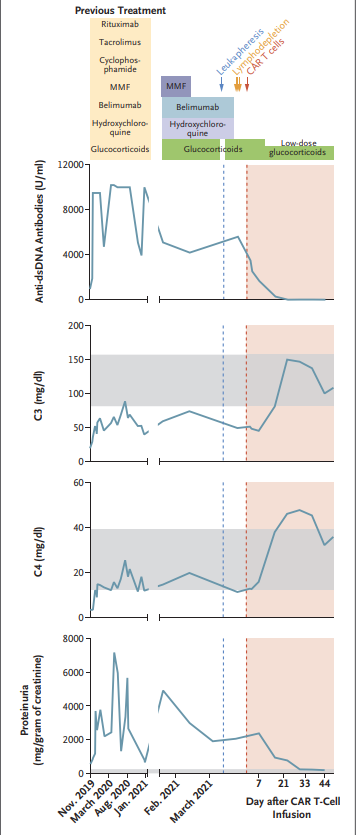
《新英格兰医学杂志》(NEJM)今年发表了Mougiakakos等关于CAR T细胞治疗难治性SLE的通讯文章[10]。一名20岁重度难治性女性SLE患者接受自体CD19CAR T细胞治疗后,临床病情与血清学指标同步缓解。该病例报告提示CD19 CAR T细胞疗法可能使难治性SLE缓解。鉴于B细胞在各种严重自身免疫病中的作用,靶向B细胞抗原的CAR T细胞疗法的疗效及可行性需进一步研究(参见《NEJM | CAR T有望治愈难治性系统性红斑狼疮》)。
CAR T细胞治疗前后的指标变化

1. 干燥综合征分子分型推动精准治疗
Soret等2021年在Nat Commun发文,分析了300多名欧洲干燥综合征(SS)患者队列的全血样本,采用转录组学、基因组学、表观遗传学、细胞因子表达和流式细胞术数据,结合相关临床参数,确定了SS患者的四个具有不同免疫失调模式的亚组(C1-C4)。C1组具有最强的Ⅰ型和Ⅱ型基因富集的IFN特征,表达Ⅰ型和Ⅱ型IFN丰度高于C3(中等)和C4(最低),C4组具有较强的Ⅰ型与中等的Ⅱ型基因富集,而C3组则相反,C2组表现出较弱的Ⅰ型和Ⅱ型IFN特征[11]。将疾病分为不同亚组有助于对疾病的理解,以及在临床试验中评估患者对治疗的反应。
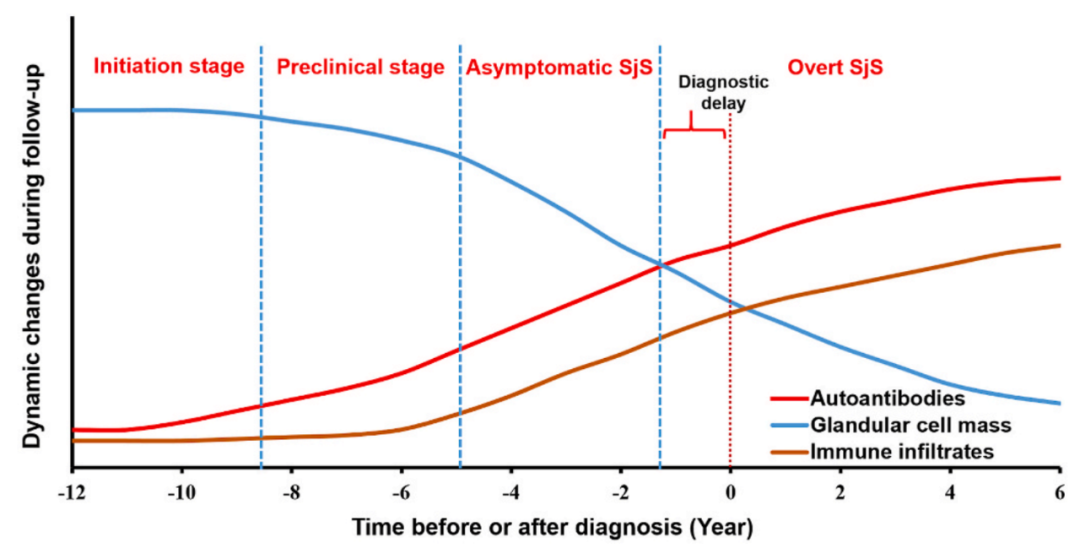
2. 提高对干燥综合征早期阶段的认知,有助于早期诊断
2021年,J Autoimmun发表的文章提出SS在早期诊断和治疗方面仍存在挑战和未满足的需求[12]。例如患者初次诊断时就已出现明显的腺体功能障碍,提示诊断明显延误。文章指出,SS可分为四个阶段:起始阶段、临床前阶段、无症状阶段和临床阶段。寻找对早期识别SS有帮助的生物标志物,有助于对高危人群实施监测及早期诊断,如腺上皮细胞中免疫相关分子的异常表达、唾液和泪液中免疫成分或表达水平的变化以及新型自身抗体如抗唾液蛋白-1(SP-1)抗体等。另外,建立发病或进展的风险预测模型有重要意义,但这方面的研究还很有限。
1. 2021ACR大血管炎治疗指南发布,基于循证医学证据对临床诊疗提供指导
美国风湿病学会(ACR)和血管炎基金会(VF)发表了2021年巨细胞动脉炎(GCA)和大动脉炎(TAK)治疗指南。对于GCA,在诊断性检查方面,建议疑似患者在开始口服GC的2周内行单侧、长节段(>1cm)颞动脉活检,建议新诊断的患者行无创性血管成像来评估大血管受累;在药物治疗方面,建议新诊断的、无脑缺血表现的患者起始治疗为每日口服大剂量GC联合托珠单抗,建议有视力损伤风险的患者起始治疗为静脉GC,建议活动性颅外大血管受累、在接受中高剂量GC治疗出现疾病复发及伴有脑缺血症状的患者口服GC联合非GC免疫抑制剂治疗,建议有严重或血流受限的椎动脉或颈动脉受累的患者加用阿司匹林[13]。
对于TAK,在药物治疗方面,建议活动性、重症患者起始治疗为大剂量口服GC联合非GC免疫抑制剂,病情缓解≥6~12个月后逐渐减停,建议难治性患者加用TNF抑制剂,建议影像学上既往血管病变出现无症状进展、但无炎症迹象的患者继续当前治疗要优于强化/改变免疫抑制治疗。而活动性TAK伴严重颅脑或椎基底动脉受累的患者应加用阿司匹林或其他抗血小板治疗。
2. ACR首个结节性多动脉炎治疗指南发布,在诊断策略和药物治疗方面提供指导
ACR和VF在2021年还联合发布了首个结节性多动脉炎(PAN)治疗指南,在辅助检查方面建议疑似/存在严重腹部受累病史的患者进行腹部血管影像学检查;在治疗方面,对于新诊断为活动性、重症PAN的患者,有条件地建议起始治疗为环磷酰胺和大剂量GC,优于单用大剂量GC,且环磷酰胺联合GC优于利妥昔单抗联合GC[14]。而对于非重症PAN患者,有条件地建议使用免疫抑制剂和GC联合优于单用GC。对于非环磷酰胺的免疫抑制剂联用GC难以控制病情的患者,可换用环磷酰胺。新确诊、经环磷酰胺治疗实现缓解的患者可换用另一种免疫抑制剂进行维持缓解治疗。
2021年,ACR和VF还发布了抗中性粒细胞胞质抗体(ANCA)相关性血管炎的管理指南,对于疾病活动、缓解等名词给出了具体定义,为活动性、重症肉芽肿性多血管炎/显微镜下多血管炎(GPA/MPA)患者以及处于不同疾病阶段的嗜酸性肉芽肿性多血管炎(EGPA)患者的诱导缓解治疗和维持治疗给予了建议[15]。
1. 系统性硬化症-间质性肺病新药物
肺间质病变是系统性硬化症患者预后不佳的主要原因。2021年发表于Lancet Respir Med为期52周的临床研究SENSCIS是目前尼达尼布针对系统性硬化症相关间质性肺疾病(SSc-ILD)患者的最大规模随机对照试验,对比了138例同时应用MMF和尼达尼布的患者和140例单独应用MMF患者的肺功能变化情况,结果显示联合应用组用力肺活量(FVC)平均年下降率较单用MMF组减少26.3ml。联合应用组中有29%的患者FVC下降率大于3.3%,而在单独应用MMF组中为40%[16]。结果表明,尼达尼布可减缓SSc-ILD患者的肺功能下降,MMF和尼达尼布联合应用为SSc-ILD患者提供了一种安全的治疗选择,但仍需更多的数据来比较初始联合治疗相对于序贯治疗的益处。
2. 骨关节炎QTL定位指导药物开发
骨关节炎(OA)是一种常见的致残性疾病,目前缺乏有效治疗方法。Steinberg等在Nat Commun上发表研究,将遗传学与转录组学及蛋白质组学相结合,通过分析115例OA患者的软骨和滑膜,发现受损较重及受损轻微组织的分子特征,在不同组织和组学水平构建分子性状位点,确定OA相关遗传信号的可能效应基因,在疾病的病因学方面提出新见解,为药物研发提供方向[17]。
3. 长效IL-2有望用于临床
低剂量IL-2的疗效已经在多种自身免疫病的临床试验中得到证明,有着很好的临床前景。但其半衰期短,需要频繁给药以维持疗效,这为临床应用带来不便。2021年,Nat Bio Eng发表了张烜和周德民团队的研究,通过对IL-2上特定位点进行聚乙二醇(PEG)修饰,获得长效IL-2,诱导调节T细胞(Treg)活化并扩增,从而减轻炎症免疫反应。此研究有望进一步转化,使IL-2的应用更为方便可行[18]。
以上为2021年风湿免疫领域的主要临床进展,其对认识发病机制、进一步研究以及指导临床实践有重要意义。
作者介绍
参考文献
2. Fraenkel L, Bathon JM, England BR, et al. 2021 American College of Rheumatology guideline for the treatmentof rheumatoid arthritis. Arthritis Care Res (Hoboken) 2021;73:924-939.
3. Lillegraven S, Paulshus Sundlisaeter N, Aga AB, et al. Effect of half-dose vs stable-dose conventional synthetic disease-modifying anti-rheumatic drugs on disease flares in patients with rheumatoid arthritis in remission: The ARCTIC REWIND randomized clinical trial. JAMA 2021;325:1755-1764.
4. Tascilar K, Hagen M, Kleyer A et al. Treatment tapering and stopping in patients with rheumatoid arthritis in stable remission (RETRO): a multicentre, randomised, controlled, open-label, phase 3 trial. Lancet Rheumatol 2021;3:E767-E777.
5.Sun X, Li R, Cai Y, et al. Clinical remission of rheumatoid arthritis in amulticenter real-world study in Asia-Pacific region. Lancet Reg Health West Pac 2021;15:100240.
6.Melki I, Allaeys I, Tessandier N, et al. Platelets release mitochondrial antigens in systemic lupus erythematosus. Sci Transl Med 2021;13.
7. Oku K, Hamijoyo L, Kasitanon N, et al. Prevention of infective complications in systemic lupus erythematosus: A systematic literature reviewfor the APLAR consensus statements. Int J Rheum Dis 2021;24:880-895.
8. Rovin BH, Teng YKO, Ginzler EM, et al. Efficacy and safety of voclosporin versus placebo for lupus nephritis (AURORA 1): A double-blind, randomised, multicentre, placebo-controlled, phase 3 trial. Lancet 2021;397:2070-2080.
9. Zhang X, Feng R, Shao M, et al. Low-dose interleukin-2 as analternative therapy for refractory lupus nephritis. Rheumatol Ther 2021;8:1905-1914.
10. Mougiakakos D, Kronke G, Volkl S, et al. CD19-targeted CAR T cells inrefractory systemic lupus erythematosus. N Engl J Med 2021;385:567-569.
11. Soret P, Le Dantec C, Desvaux E, et al. A new molecular classificationto drive precision treatment strategies in primary Sjogren's syndrome. Nat Commun 2021;12:3523.
12. Wang B, Chen S, Zheng Q, et al. Early diagnosis and treatment for Sjogren's syndrome: Current challenges, redefined disease stages and future prospects. J Autoimmun 2021;117:102590.
13. Maz M, Chung SA, Abril A, et al. 2021 American College Of Rheumatology/Vasculitis Foundation guideline for the management of giant cellarteritis and Takayasu arteritis. Arthritis Rheumatol 2021;73:1349-1365.
14. Chung SA, Gorelik M, Langford CA, et al. 2021 American College Of Rheumatology/Vasculitis Foundation guideline for the management of polyarteritis nodosa. Arthritis Rheumatol 2021;73:1384-1393.
15. Chung SA, Langford CA, Maz M, et al. 2021 American College Of Rheumatology/Vasculitis Foundation guideline for the management of antineutrophil cytoplasmic antibody-associated vasculitis. Arthritis Care Res(Hoboken) 2021;73:1088-1105.
16. Highland KB, Distler O, Kuwana M, et al. Efficacy and safety of nintedanib in patients with systemic sclerosis-associated interstitial lung disease treated with mycophenolate: A subgroup analysis of the SENSCIS trial. Lancet Respir Med 2021;9:96-106.
17. Steinberg J, Southam L, Roumeliotis TI, et al. A molecular quantitative trait locus map for osteoarthritis. Nat Commun 2021;12:1309.
18. Zhang B, Sun J, Wang Y, et al. Site-specific pegylation of interleukin-2 enhances immunosuppression via the sustained activation of regulatory T cells. Nat Biomed Eng 2021;5:1288-1305.
本文由嘉会医学研究和教育集团(J-Med)与《新英格兰医学杂志》(NEJM)联手打造的《NEJM医学前沿》翻译、编写或约稿。中译全文及所含图表等由NEJM集团独家授权。如需转载,请留言或联系nejmqianyan@nejmqianyan.cn。未经授权的翻译是侵权行为,版权方保留追究法律责任的权利。
版权所有 © 北京大学人民医院风湿免疫研究所
技术支持:优河马